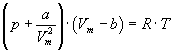
Die van-der-Waals Gleichung
Die van-der-Waals Gleichung
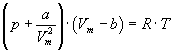
gibt das Verhalten realer Gase außerhalb des Koexistenzbereiches der flüssigen und der gasförmigen Phase (hellgrün) in guter Näherung wieder.
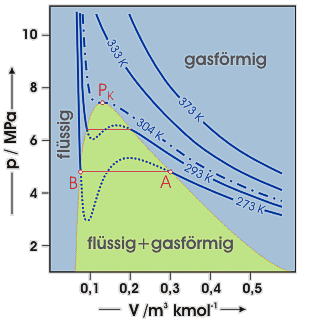
Van-der-Waals-Isothermen von Kohlendioxid
Innerhalb des Koexistenzbereichs dagegen zeigen die van-der-Waals Isothermen einen s-förmigen Verlauf (punktiert,, beispielsweise zwischen A und B), der durch entsprechende waagerechte Geradenstücke, die den konstanten (temperaturabhängigen) Sättigungsdampfdruck angeben, zu ersetzen (rot) ist. Oberhalb der kritischen Temperatur (strichpunktierte Isotherme) ist nur der gasförmige Zustand möglich.