Mögliche Phasenübergänge
Es sind unterschiedliche Phasenübergänge möglich, die hier am Beispiel des Wassers erläutert werden sollen:
Wenn wir festes Wasser (Eis) erwärmen, so schmilzt es und wird zu flüssigem
Wasser. Dies ist der Phasenübergang fest![]() flüssig.
Das Wasser verdampft und wir erhalten als Resultat des Phasenübergangs
flüssig
flüssig.
Das Wasser verdampft und wir erhalten als Resultat des Phasenübergangs
flüssig![]() gasförmig
den gasförmigen Wasserdampf. Weniger bekannt ist, dass Eis sich auch direkt
in Wasserdampf umwandeln kann. Dieser als Sublimation bezeichnete Phasenübergang
fest
gasförmig
den gasförmigen Wasserdampf. Weniger bekannt ist, dass Eis sich auch direkt
in Wasserdampf umwandeln kann. Dieser als Sublimation bezeichnete Phasenübergang
fest![]() gasförmig
kann aber z. B. an trockenen Wintertagen häufig beobachtet werden. Für
jeden dieser Phasenübergänge, die in der Abbildung rot dargestellt
sind, muss Energie (z.B. in Form von Wärme) zugeführt werden.
gasförmig
kann aber z. B. an trockenen Wintertagen häufig beobachtet werden. Für
jeden dieser Phasenübergänge, die in der Abbildung rot dargestellt
sind, muss Energie (z.B. in Form von Wärme) zugeführt werden.
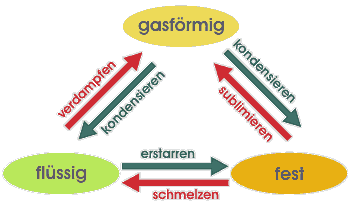
Mögliche Phasenübergänge
Natürlich können die oben beschriebenen Umwandlungsprozesse auch
umgekehrt durchlaufen werden: Wasserdampf kann zu Wasser (gasförmig![]() flüssig)
oder zu Eis (gasförmig
flüssig)
oder zu Eis (gasförmig![]() fest)
kondensieren und Wasser kann zu Eis erstarren (flüssig
fest)
kondensieren und Wasser kann zu Eis erstarren (flüssig![]() fest).
Bei diesen in der Abbildung grün dargestellten Phasenübergängen
wird jeweils die Energie wieder frei, die bei der Hintransformation aufgewendet
werden musste.
fest).
Bei diesen in der Abbildung grün dargestellten Phasenübergängen
wird jeweils die Energie wieder frei, die bei der Hintransformation aufgewendet
werden musste.
Sie hier gemachten Aussagen gelten natürlich nicht nur für Wasser, sondern genauso für jeden anderen Stoff.