Phasendiagramm von Wasser -nicht maßstäblich-
(Tipp: Der Mauscursor zeigt weitere Informationen)
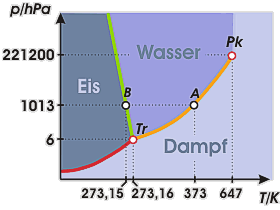
Phasendiagramm von Wasser
Diese Abbildung zeigt das Phasendiagramm eines Stoffes mit fallender Schmelzkurve am Beispiel des Wassers.

Phasendiagramm von Wasser -nicht maßstäblich-
(Tipp: Der Mauscursor zeigt weitere Informationen)
Die Dampfdruckkurve (orange), die Schmelzkurve (grün) und die Sublimationskurve (rot) scheiden sich im Tripelpunkt Tr, der für Wasser bei 273,16 K (0,01 °C) und 6,1 hPa liegt. Bei einer Temperatur von 647 K endet die Dampfdruckkurve im kritischen Punkt Pk. Wir wissen, dass bei Temperaturen oberhalb der kritischen Temperatur lediglich die Gasphase existieren kann.
Das Phasendiagramm eignet sich gut, um einen Überblick über die unter bestimmten Bedingungen im Gleichgewicht vorliegenden Phasen zu erlangen: Kühlen wir beispielsweise Wasserdampf unter Normaldruck (1013 hPa) langsam ab, so beginnt dieser im Punkt A (373 K / 100 °C) zu kondensieren. Im Punkt B (273 K / 0 °C) schließlich erstarrt das flüssige Wasser zu Eis. Oberhalb von A ist nur die Gasphase stabil, zwischen A und B nur die flüssige und unterhalb von B nur die feste Phase.