Phasendiagramm von Kohlendioxid -nicht maßstäblich-
(Tipp: Der Mauscursor zeigt weitere Informationen)
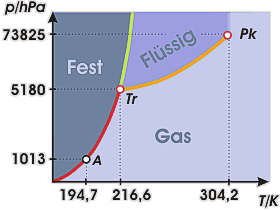
Phasendiagramm von Kohlendioxid
Diese Abbildung zeigt das Phasendiagramm eines typischen Stoffes am Beispiel des Kohlendioxids.

Phasendiagramm von Kohlendioxid -nicht maßstäblich-
(Tipp: Der Mauscursor zeigt weitere Informationen)
Die Dampfdruckkurve (orange), die Schmelzkurve (grün) und die Sublimationskurve (rot) schneiden sich im Tripelpunkt Tr. Für Kohlendioxid liegt dieser bei 216,55 K (-56,6 °C) und etwa 5180 hPa. Bei einer Temperatur von 304,2 K endet die Dampfdruckkurve im kritischen Punkt Pk. Bei Temperaturen oberhalb der kritischen Temperatur kann lediglich die Gasphase existieren.
Wir erkennen weiterhin, dass Kohlendioxid bei Normaldruck (1013 hPa) niemals in der flüssigen Form existieren kann. Festes Kohlendioxid sublimiert daher bei Normaldruck und Temperaturen oberhalb von 194,7 K (-78,6 °C). Im Punkt A sind feste und gasförmige Phase im Gleichgewicht. Da bei dieser Umwandlung die flüssige Phase nicht auftritt, ist festes Kohlendioxid auch als "Trockeneis" bekannt. Es wird in der Lebensmittelindustrie, für Reinigungszwecke und zur Erzeugung künstlichen Nebels verwendet.