Selbsttest-Aufgaben
Zum Verdampfen von eines Kilogramms Wasser
muss die Verdampfungswärme von 2260 kJ aufgebracht werden (siehe Tabelle).
Bis in welche Höhe könnte - bei äquivalentem Energieaufwand -
die gleiche Menge Wasser angehoben werden?

Zum Heben einer Masse m auf die
Höhe h muss die Hubarbeit
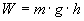
geleistet werden (g bezeichnet die
Erdbeschleunigung). Stellen wir dies nach h um,
so erhalten wir
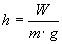
Nun soll W gleich der Verdampfungswärme
sein. Einsetzen dieses und der anderen Werte liefert
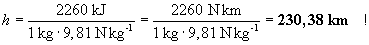
Zum Verdampfen einer bestimmten Menge Wasser muss also so viel
Energie aufwendet werden, wie notwendig wäre, um die gleiche Menge 26
mal (!) auf den höchsten Berg der Erde, den Mount Everest (8850 m), zu
heben.

Wie viel Energie ist aufzubringen um 1 kg
Wassereis mit der Temperatur von -50 °C bei konstantem Druck (1013 hPa)
in Wasserdampf mit einer Temperatur von 200 °C zu verwandeln? Die spezifische
Wärmekapazität von Eis ist cp
= 2,10 kJ Kg-1 K-1 , die von Wasser 4,19 kJ Kg-1
K-1 und die von Wasserdampf 1,93 kJ Kg-1 K-1.
Die spezifische Schmelzwärme ist QS
= 335 kJ Kg-1 und die spezifische Verdampfungswärme QV
= 2260 kJ Kg-1. Welcher Prozentsatz ist für die Phasenübergänge
aufzuwenden?

Zunächst ist das Eis um 50 K auf 0 °C zu erwärmen.
Dazu ist die Energie
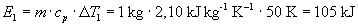
notwendig. Für das Schmelzen des Eises ist die Schmelzwärme
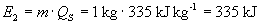
erforderlich. Die anschließende Erwärmung des Wassers
auf 100 °C erfordert die Energie von
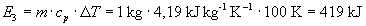 .
.
Für das Verdampfen des Wassers die Verdampfungswärme
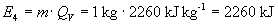
benötigt und für die Erhitzung des Dampfes von 100
°C auf 200 °C nochmals
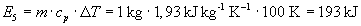
Insgesamt wird die Energie
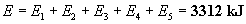
benötigt. Für die Phasenübergänge werden
die Schmelzwärme E2 und die Verdampfungswärme E4
aufzubringen, daher entfallen
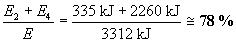
der Energie auf die Phasenübergänge!

![]()
![]()