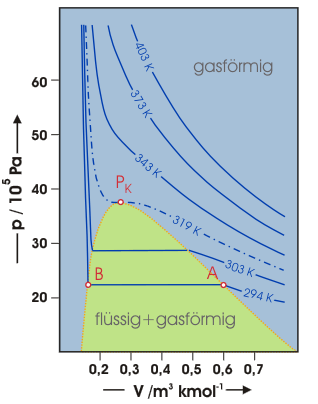
Temperaturabhängigkeit des Koexistenzbereichs
Führen wir das beschriebene Experiment für verschiedene Temperaturen durch und tragen jeweils die ermittelten Isothermen in das pV-Diagramm ein, so ergibt sich etwa das in der Abbildung skizzierte Diagramm.

pV-Diagramm von Schwefelhexafluorid bei unterschiedlichen Temperaturen
Die Punkte A und B legen die Grenze des Koexistenzbereichs gasförmig-flüssig für die betrachtete Temperatur fest. Mit steigender Temperatur wird der Abstand zwischen A und B immer geringer. Der Koexistenzbereich, der in der Abbildung grün dargestellt ist, wird also mit steigender Temperatur immer schmaler. Bei noch höheren Temperaturen fallen schließlich beide Punkte A und B in einem Punkt PK zusammen. PK bezeichnet den sogenannten kritischen Punkt, der auf der kritischen Isotherme (strichpunktiert) liegt. Diese ist durch die kritische Temperatur (319 K) bestimmt. Unterhalb der kritischen Isotherme existiert rechts neben dem Koexistenzberich nur die gasförmige Phase, links von ihm nur die flüssige Phase. Bei Temperaturen oberhalb der kritischen Temperatur können flüssige und gasförmige Phase nicht mehr nebeneinander bestehen. Es gibt hier keinen definierten Übergang zwischen Gas und Flüssigkeit mehr. Für sehr hohe Temperaturen gehen die van-der-Walls-Isothermen schließlich in die Hyperbeln des idealen Gases über.