Interaktives Experiment zur Kaloriemetrie
Das unten abgebildete Kalorimeter enthält 1l Wasser bei einer Temperatur von
20° C. Das Kalorimetergefäß hat eine Wärmekapazität von 40 J·K-1.
In das Wasserbad können Sie Probemassen unterschiedlicher Substanzen einbringen.
Auch die Temperatur der Probekörper können Sie wählen. Die Mischungstemperatur
ist am Thermometer abzulesen. Sie können danach einen neuen Versuch starten.
Verifizieren Sie die spezifische Wärmekapazität
der Wasserfüllung.

Zunächst stellen wir die Gleichung
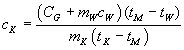
um und lösen nach der spezifischen Wärmekapazität cW
der Wasserfüllung auf:
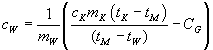
Nun können wir unser Experiment starten. Um eine möglichst große
Temperaturänderung zu erhalten, wählen wir einen Probekörper
mit großer Masse mK, hoher Temperatur
tK und hoher spezifischer Wärmekapazität
cK. Wir wählen z.B. 500 g Aluminium
bei 500 °C . Führen Sie das Experiment aus. Sie beobachten eine Mischungstemperatur
tM = 66 °C. Diese Werte und die
Wärmekapazität des Kalorimeters setzen wir in die Gleichung ein
und erhalten:
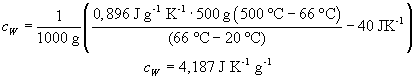
Dies ist in guter Übereinstimmung mit dem Literaturwert cW = 4,182 J·g-1·K-1!

Bestimmen Sie die spezifische Wärmekapazität
von Kupfer.

Die Wärmekapazität von Kupfer können wir mit Hilfe der Gleichung
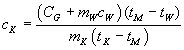
bestimmen. Wählen wir für unser Experiment z.B. 500 g Kupfer bei
500 °C, so beobachten wir die Mischungstemperatur tM
= 41 °C. Setzen wir diese Werte, die spezifische Wärmekapazität
von Wasser, cW = 4,182 J·g-1·K-1,
und die des Kalorimeters, CG = 40 J·K-1, ein,
so erhalten wir:
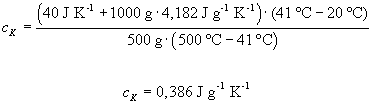

![]()
![]()