Isotherme Zustandsänderung
Betrachtet man den Zusammenhang zwischen Gasdruck und Volumen einer bestimmten
Menge eines Gases bei konstanter Temperatur, so spricht man von einer isothermen
Zustandsänderung. Komprimiert man ein Gas isotherm, so steigt
sein Druck. Bei der Expansion fällt er. Für ein ideales Gas wird dies
durch das Boyle-Mariotte'sche Gesetz beschrieben:
Bei konstanter Temperatur T
ist das Produkt aus Druck p und Volumen V
eines idealen Gases konstant.
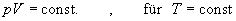
(Boyle-Mariotte'sches Gesetz) |
Die möglichen Zustände bei einer festen Temperatur, die sogenannten
Isothermen. Diese liegen also auf Hyperbelästen, wie der
graphischen Darstellung zu entnehmen
ist.
Wenn man also den Druck auf ein Gas erhöht, so verringert sich sein Volumen,
d.h. seine Dichte steigt an. Dies hat u. a. Konsequenzen für den Luftdruck
in unserer Atmosphäre.
Das Boyle-Mariotte'sche Gesetz gilt streng nur für ideale
Gase. Für stark verdünnte reale Gase gilt es in guter Näherung.
So wird es beispielsweise von Edelgasen und Luft schon bei Normaldruck und Zimmertemperatur
recht gut erfüllt.
Selbsttest

|



