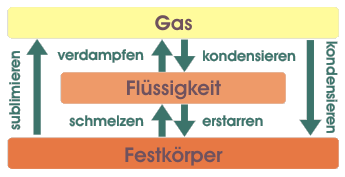
Mögliche Phasenübergänge
Phasenübergänge
Im festen Körper schwingen alle Atome um ihre Gleichgewichtslagen im Kristallgitter. Wird nun die thermische Energie erhöht, so werden die Schwingungen immer stärker bis schließlich die Schmelztemperatur erreicht ist. Wird jetzt weiterhin Energie zugeführt, so wird diese zum Aufbrechen der Kristallbindungen verwendet: Der regelmäßige Aufbau des Kristallgitters wird zerstört, der Körper schmilzt und wird zur Flüssigkeit. Während dieses Prozesses bleibt die Temperatur konstant. Man nennt dies einen Phasenübergang.
Jeder kennt die Phasenübergänge des Wassers aus dem Alltag: Wenn wir festes Eis erwärmen, so schmilzt es und wird zu flüssigem Wasser. Dies ist der Phasenübergang fest-flüssig. Erhitzen wir das Wasser weiter, verdampft es schließlich und wir erhalten als Resultat des Phasenübergangs flüssig-gasförmig den gasförmigen Wasserdampf. Weniger bekannt ist, dass Eis sich auch direkt in den gasförmigen Zustand umwandeln kann. Diese als Sublimation bezeichnete Phasenumwandlung kann aber z. B. an trockenen Wintertagen häufig beobachtet werden.

Mögliche
Phasenübergänge
Natürlich kann man den Prozess auch umkehren: Wasserdampf kann zu Wasser kondensieren das wiederum zu Eis erstarren kann. In der Graphik sind alle möglichen Phasenübergänge zusammengefasst. Sie gelten natürlich nicht nur für Wasser, sondern genauso für jeden anderen Stoff.
Anmerkung: Phasenübergänge werden ausführlich der SLE "Phasenübergänge" behandelt.